图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t2℃下甲、乙两种物质和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )
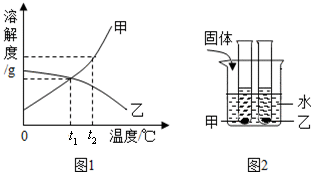
- A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为:甲>乙
- B.将甲、乙两种物质的饱和溶液都从t2℃降至t1℃时,两种溶液中溶质的质量分数相等
- C.向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小
- D.向烧杯的水中加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出
答案
正确答案:B
知识点:溶解度曲线的应用
A.一定温度下,溶解度越大,饱和溶液的溶质质量分数越大,t2℃时甲的溶解度大于乙的溶解度,则饱和溶液中溶质质量分数大小关系为:甲>乙,A正确。
B.将甲、乙两种物质的饱和溶液都从t2℃降至t1℃时,由于甲的溶解度随温度的降低而减小,甲仍为饱和溶液,最终得到的甲溶液的溶质质量分数等于t1℃时甲的饱和溶液的溶质质量分数;而乙的溶解度随温度的降低而增大,乙溶液从饱和溶液变为不饱和溶液,溶液组成不变,溶液的溶质质量分数不变,仍为t2℃时乙的饱和溶液的溶质质量分数。从图可知:t1℃时甲的溶解度大于t2℃时乙的溶解度,溶解度越大,溶液的溶质质量分数越大,所以降温后甲的溶质质量分数大于乙的溶质质量分数,B错误。
C.NaOH固体溶于水放出大量的热,使溶液温度升高,甲的溶解度增大,甲物质逐渐溶解,溶质质量增大,溶剂不变,甲的溶质质量分数变大;而乙的溶解度减小,继续析出晶体,溶质质量减小,溶剂不变,乙的溶质质量分数减小,C正确。
D.NH4NO3固体溶于水吸收热量,使溶液温度降低,甲的溶解度减小,析出晶体;而乙的溶解度增大,变为不饱和溶液,不会析出晶体,D正确。
故选B。
略








