为了测定一瓶过氧化氢溶液的溶质质量分数,取17.0g过氧化氢溶液于烧杯中,加入0.2g二氧化锰,充分反应至烧杯中物质质量不再减轻,称量烧杯中剩余物质质量为16.8g,假设生成的气体全部逸出,则这瓶过氧化氢溶液中溶质的质量分数为(计算结果精确到0.1%)( )
- A.2.5%
- B.5.0%
- C.7.5%
- D.10.0%
答案
正确答案:B
知识点:化学反应方程式的计算
根据质量守恒定律,反应前后减少的质量为生成O2的质量。则生成O2的质量为:
17.0g+0.2 g-16.8 g=0.4 g。要求H2O2溶液中溶质的质量分数,需要求出H2O2
溶液中H2O2的质量,H2O2质量即为参加反应的H2O2的质量,由生成O2的质量即可
求出参加反应的H2O2的质量。H2O2在MnO2作用下分解的方程式为:
2H2O2![]() 2H2O+ O2↑。
2H2O+ O2↑。
设参加反应的H2O2的质量为x,则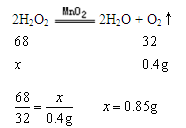
H2O2溶液中溶质的质量分数为![]()
故选B。
略







