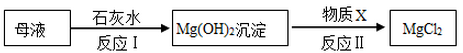我国拥有丰富的海洋资源,综合利用这些宝贵的资源有力地促进了我国经济的发展。
(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质。请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:

其中操作1的名称是 ;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称);在加热蒸发过程中,当蒸发皿中 时,停止加热。
(2)上述除去泥沙后的澄清滤液中,还含有Ca2+、Mg2+等阳离子,要想知道该滤液是硬水还是软水,可加入 进行检验。
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁。工业上从母液中提取氯化镁的过程如下:
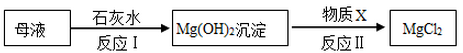
反应I的基本反应类型是 ;物质X是 (填名称)。
(4)工业上可用电解饱和NaCl溶液的方法制得烧碱、氢气和氯气,请写出该反应的化学方程式: 。
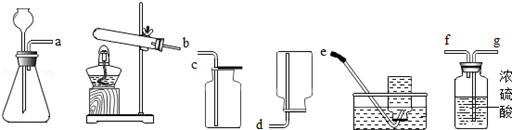
(5)从如图装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 (用接口处字母填写);
写出一个在实验室中用加热法制取氧气的化学方程式: 。
答案
(1)溶解(5分)漏斗(5分)出现较多固体(5分)
(2)肥皂水(5分)
(3)复分解反应(5分)盐酸(5分)
(4)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑(15分)
2NaOH+H2↑+Cl2↑(15分)
(5)agfd(15分)
2KMnO4![]() K2MnO4+MnO2+O2↑(或2KClO3
K2MnO4+MnO2+O2↑(或2KClO3 ![]() 2KCl+3O2↑)(10分)
2KCl+3O2↑)(10分)
知识点:综合应用题
本题以海水的综合利用为载体,考查与之相关的实验操作,药品的选用和化学方程式的书写。
(1)除去粗盐中泥沙等杂质的步骤包括溶解、过滤和蒸发;过滤操作中需要用到的玻璃仪器主要有烧杯、玻璃棒和漏斗;在加热蒸发过程中,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,以防晶体迸溅。
(2)含有较多可溶性钙、镁化合物的水叫做硬水,不含或含较少可溶性钙、镁化合物的水叫做软水。区分硬水和软水的方法是:加入肥皂水,产生泡沫多的是软水,产生浮渣多的是硬水。
(3)反应I的化学方程式为MgCl2+2NaOH=Mg(OH)2↓+2NaCl,是两种化合物相互交换成分,生成另外两种化合物的反应,属于复分解反应;反应II将碱转化成了盐,应该加入酸,结合生成的盐是MgCl2,所以应加入盐酸。
(4)根据题中给出的信息,可知反应物为NaCl和H2O,生成物为NaOH、H2和Cl2,据此可写出化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(5)在实验室中,常用锌粒与稀硫酸在常温下制取氢气,属于固液常温制气体,故选择第一套装置为气体发生装置。要得到干燥的氢气,制取的氢气从a处导出后,首先需要通过g处进入浓硫酸进行干燥,然后从f处导出后再进入d处,用向下排空气法收集,这里不使用排水法收集的原因是排水法不能得到干燥的氢气。实验室中常见的用加热法制取氧气的方法有两种,一是高锰酸钾加热分解为锰酸钾、二氧化锰和氧气;二是氯酸钾在二氧化锰催化条件下加热,分解为氯化钾和氧气。
略