在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-的浓度分别为
Amol•L-1与Bmol•L-1,则A和B的关系为( )
- A.A
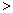 B
B - B.A=10-4B
- C.B=10-4A
- D.A=B
答案
正确答案:B
NaOH溶液中H+的浓度为1×10-9mol•L-1,NaOH在水中不会电离出H+,因此该溶液中的H+全部是由水电离产生的,由于水电离产生的H+和OH-的物质的量是相等的,因此由水电离出的c(OH-)也为1×10-9mol•L-1,即A=1×10-9mol•L-1。CH3COONa是强碱弱酸盐,CH3COO-在水中会发生水解,促进水的电离,CH3COONa在水中不会电离出OH-,因此溶液中的OH-全部是由水电离产生的,c(H+)=1×10-9mol•L-1,由水的离子积可知c(OH-)=1×10-5mol•L-1,即B=1×10-5mol•L-1。综上,A=10-4B。
故选B。
略







