已知Mg能在CO2气体中燃烧(CO2+2Mg 2MgO+C)。若将6g镁粉在下列不同条件下点燃:
2MgO+C)。若将6g镁粉在下列不同条件下点燃:
(1)在足量CO2中,反应结束后所得固体的质量 。
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为 。
答案
(1)11.5g(5分);(2)10g(5分)。
知识点:化学方程式计算
(1)在足量CO2中点燃,设生成氧化镁的质量为x、生成碳的质量为y,则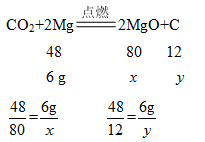
解得x=10 g,y=1.5 g
则反应结束后所得固体的质量为10 g+1.5 g=11.5 g。
(2)镁粉在CO2和O2的混合气体中点燃,发生反应的方程式为CO2+2Mg![]() 2MgO+C、O2+2Mg
2MgO+C、O2+2Mg![]() 2MgO,反应后O2有剩余,生成的C会继续与O2反应C +O2
2MgO,反应后O2有剩余,生成的C会继续与O2反应C +O2![]() CO2,则最终得到的固体为MgO,根据质量守恒定律可知,Mg全部转化到MgO中,生成的MgO中Mg元素的质量为6 g,则生成MgO的质量为
CO2,则最终得到的固体为MgO,根据质量守恒定律可知,Mg全部转化到MgO中,生成的MgO中Mg元素的质量为6 g,则生成MgO的质量为![]() 。
。
略







