钠及其化合物是中学化学学习和研究的重要内容。
(1)下图是钠的原子结构示意图。下列说法不正确的是 。
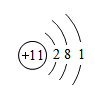
a.钠属于金属元素
b.钠原子的质子数为11
c.钠离子的符号为Na+
d.钠在化学反应中易得到电子
(2)钠与水反应生成氢氧化钠和氢气,化学方程式为 ;
小苏打受热分解生成碳酸钠、二氧化碳和水,化学方程式为 。
(3)配制一瓶下图溶液需氯化钠 g;配制50 g 6%的氯化钠溶液,若用量
筒量取水时俯视读数(其他操作正确),则溶液的质量分数 6%(填“ ”、
”、
“ ”或“
”或“ ”)。
”)。

(4)已知:2Na2O2+2H2O 4NaOH+O2↑;2Na2O2+2CO2
4NaOH+O2↑;2Na2O2+2CO2 2Na2CO3+O2↑。
2Na2CO3+O2↑。
实验室敞口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,
加足量水,可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要
写出实验步骤和现象)
(5)钛和钛合金性能优良,广泛用于航空、造船和化学工业中。工业上常用钠
来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛。若要用该
方法制取2.4 kg钛,理论上需要钠的质量是多少?(Ti的相对原子质量为48)
答案
(1)d(3分)
(2)2Na+2H2O![]() 2NaOH+H2↑(5分),2NaHCO3
2NaOH+H2↑(5分),2NaHCO3![]() Na2CO3+H2O+CO2↑(5分)
Na2CO3+H2O+CO2↑(5分)
(3)4.5(5分)![]() (5分)
(5分)
(4)有气泡产生(3分)。向该试管中滴加足量的CaCl2溶液(或BaCl2溶液等),
静置,取上层清液,向其中滴加酚酞溶液,溶液变红(8分)。
(5)解:设理论上需要钠的质量为![]() 。(2分)
。(2分)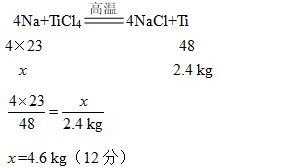
答:设理论上需要钠的质量为4.6 kg。(2分)
知识点:综合应用题
(1)钠属于金属元素,由其原子结构示意图可知钠原子的质子数为11,钠原子的最外层有1个电子,在化学反应中容易失去电子,形成钠离子Na+,因此只有d符合题意。
(2)钠和水反应生成氢氧化钠和氢气,化学方程式为2Na+2H2O![]() 2NaOH+H2↑,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,化学方程式为2NaHCO3
2NaOH+H2↑,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(3)配制500 mL质量分数为0.9%的氯化钠溶液需要NaCl的质量为500 mL×1.0
g/mL×0.9%=4.5 g;配制50g 6%的氯化钠溶液,若用量筒量取水时俯视读数,则实际量取的水的体积比计算值小,造成溶液的质量分数大于6%。
(4)实验室敞口放置的过氧化钠已部分变质,则其中含有Na2O2、NaOH和
Na2CO3,取少量该固体样品于试管中,加足量水,Na2O2与H2O反应会放出氧气,可观察到有气泡产生。要想检验该水溶液中含有的NaOH,可用酸碱指示剂,但是由于Na2CO3溶液也显碱性,所以需要先排除Na2CO3的干扰,具体的操作是:向该试管中滴加足量的CaCl2溶液(或BaCl2溶液),静置,取上层清液,向其中滴加酚酞溶液,溶液变红。
(5)在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛,可知反应的化学方程式为4Na+TiCl4![]() 4NaCl+Ti,可设理论上需要钠的质量为
4NaCl+Ti,可设理论上需要钠的质量为![]() ,已知生产的Ti的质量为2.4kg,根据化学方程式可求出需要钠的质量。
,已知生产的Ti的质量为2.4kg,根据化学方程式可求出需要钠的质量。
略









