烧杯中盛有BaCl2和盐酸的混合溶液100.0g,向其中滴加溶质的质量分数为10.0%的
Na2CO3溶液,烧杯中溶液的质量与滴加Na2CO3溶液的质量关系如图所示。下列说法正确的是( )
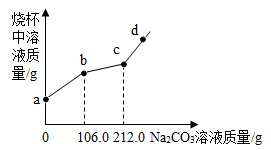
- A.ab段产生白色沉淀
- B.bc段溶液质量增加86.3g
- C.c点对应溶液的溶质的质量分数为7.5%
- D.向d点溶液中滴加酚酞溶液,溶液显无色
答案
正确答案:B
将Na2CO3溶液不断滴加到BaCl2和盐酸的混合溶液中,Na2CO3首先和盐酸反应,然后再和BaCl2反应,反应的化学方程式为Na2CO3+ 2HCl![]() 2NaCl+CO2↑+ H2O,BaCl2 + Na2CO3
2NaCl+CO2↑+ H2O,BaCl2 + Na2CO3![]() BaCO3↓+ 2NaCl。根据图象可知,ab段Na2CO3和盐酸反应产生气体;bc段Na2CO3和BaCl2反应产生沉淀;cd段随着Na2CO3溶液的不断加入,烧杯中溶液的总质量持续增加。
BaCO3↓+ 2NaCl。根据图象可知,ab段Na2CO3和盐酸反应产生气体;bc段Na2CO3和BaCl2反应产生沉淀;cd段随着Na2CO3溶液的不断加入,烧杯中溶液的总质量持续增加。
A.由上述分析可知,A错误。
B.bc段Na2CO3和BaCl2反应产生沉淀,和BaCl2反应消耗Na2CO3溶液的质量为212.0 g-106.0 g=106.0 g,则Na2CO3的质量为106.0 g×10.0%=10.6g。设生成沉淀的质量为x,则

bc段溶液增加的质量为加入Na2CO3溶液的质量减去生成沉淀的质量,即106.0 g-19.7 g=86.3 g,B正确。
C.c点时Na2CO3恰好和盐酸、BaCl2完全反应,所得溶液为NaCl溶液。设Na2CO3和盐酸反应生成气体的质量为y、生成NaCl的质量为m,Na2CO3和BaCl2反应生成NaCl的质量为n,则
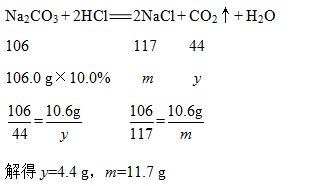
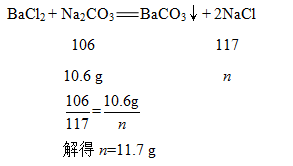
c点时所得NaCl溶液的质量为100 g+212 g-4.4 g-19.7 g=287.9 g,则NaCl溶液的溶质的质量分数为![]() ,C错误。
,C错误。
D.d点溶液中的溶质为NaCl和Na2CO3,Na2CO3溶液显碱性,故滴加酚酞溶液显红色,D错误。
故选B。
略








