酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有 生成。
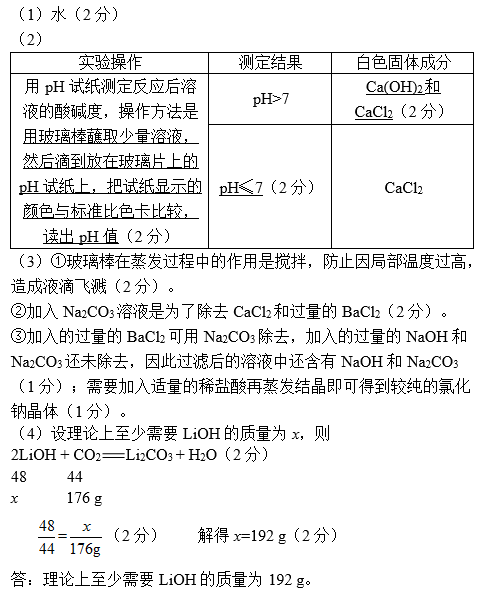
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:

实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
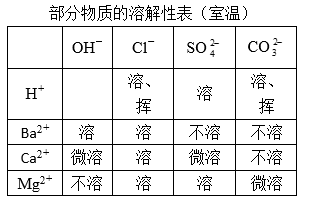
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入Na2CO3溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充。
(4)LiOH和NaOH的化学性质相似。“神舟”飞船内,可用盛有LiOH的过滤网吸收航天员呼出的气体,以降低CO2含量。请计算:用LiOH完全吸收176 gCO2生成Li2CO3和H2O,理论上至少需要LiOH的质量是多少?
答案

略









