单选题(本大题共小题, 共分)
-
1.(本小题2分)
下列变化过程中,一定发生了化学变化的是( )
-
2.(本小题2分)
下列物质排放到空气中,不会造成大气污染的是( )
-
3.(本小题2分)
发明了“联合制碱法”的科学家是( )
-
4.(本小题2分)
河南名吃胡辣汤营养美味,下列用到的食材中富含蛋白质的是( )
-
5.(本小题2分)
下列各组物质中,都由分子构成的一组是( )
-
6.(本小题2分)
如图是高温下某反应的微观过程。下列说法中正确的是( )

-
7.(本小题2分)
下列有关化学实验的说法中不正确的是( )
-
8.(本小题2分)
分类是学习和研究化学的常用方法。下列分类中正确的是( )
-
9.(本小题2分)
如图是甲、乙两种固体的溶解度曲线。下列说法中不正确的是( )

-
10.(本小题2分)
下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
-
11.(本小题2分)
下列事实的结论或解释中不正确的是( )
-
12.(本小题2分)
在一定质量的某NaCl溶液中加入足量的AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液质量的1/4。则原NaCl溶液中溶质的质量分数约为( )
解答题(本大题共小题, 共分)
-
13.(本小题4分)
元素周期表是学习化学的重要工具,如图是表中的一格,其中A表示 ;B表示 。

-
14.(本小题6分)
空气的成分中体积分数最大的是 ;人体中含量最高的金属元素是 ;形成化合物种类最多的元素是 。
-
15.(本小题6分)
食盐水中含有杂质CaCl2、Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为 ;过滤所用玻璃仪器有烧杯、玻璃棒和 。向食盐水中通NH3和CO2可制得小苏打和一种氮肥,该氮肥的化学式为 。(提示:BaSO4、BaCO3难溶于水)
-
16.(本小题4分)
一定条件下,4.8 g CH4与16.0 g O2恰好完全反应,生成10.8 g H2O、4.4 g CO2和物质X。则X的质量为 g;该反应方程式中O2与X化学计量数之比为 。
-
17.(本小题4分)
在充满CO2的铝制易拉罐中加入过量NaOH溶液后封口,易拉罐立即变瘪,原因是 ;一会儿易拉罐又鼓起,因Al与NaOH溶液反应生成H2和NaAlO2,该化学方程式为 。
-
18.(本小题8分)
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去)。

(1)若A是紫红色金属,D为难溶性碱。则D的化学式为 ,
由C转化为A的化学方程式为 。
(2)若A属于氧化物,其相对分子质量为56,A与水化合得B,C是白色难溶固体。则B的一种用途是 ,由D转化为C的化学方程式为 。
-
19.(本小题4分)
能源是人类生存和发展的基础。
(1)可燃物燃烧除需氧气外,还需满足什么条件?
(2)氢能源已被广泛关注。氢气作燃料的优点是什么?(答出一条即可)
-
20.(本小题6分)
用化学方程式表示下列反应原理。
(1)用电解水的方法制取氢气。
(2)用磁铁矿石(含Fe3O4)炼铁。
(3)实验室制取氧气。(写出一个即可)
-
21.(本小题6分)
生产、生活中常需配制溶液。

(1)配制一瓶如图所示溶液需氯化钠 g。
(2)配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液的质量分数偏小?请说明偏小的原因。
①用量筒量取水时仰视读数;
②往烧杯中加水时有水溅出;
③称量含不溶性杂质的氯化钠来配制溶液;
④将配制好的溶液往试剂瓶中转移时有少量溅出。
-
22.(本小题8分)
NaOH是化学实验中常用的试剂。
(1)将某NaOH溶液逐滴滴入一定量的某盐酸中,下边图象合理的是 (填“甲”或“乙”)。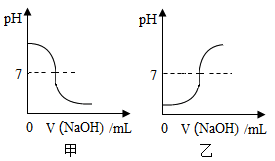
(2)向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因。
(3)向足量某NaOH溶液中通入CO2,反应后溶液中的溶质可能只有Na2CO3,也可能还有NaOH,请设计实验检验溶质的成分,简要写出实验步骤、现象和结论。(提示:Na2CO3溶液呈碱性)
-
23.(本小题20分)
化学实验是进行科学探究的重要方式。
(1)下列实验仪器中不能用于加热的是 (填字母代号)。
a.烧杯b.量筒c.试管d.蒸发皿
(2)某化学小组选用以下装置和药品进行探究实验。

①A中反应的化学方程式为 。
②若将A、B连接,A中产生的气体并不能使B中的溶液变浑浊,这是为什么?
③若要制取一瓶较为纯净、干燥的CO2,所选用装置的导管接口从左到右的正确连接顺序为:a接 、 接 、 接 。
(3)为探究工业废水的综合利用,某化学小组在实验室中完成了以下实验。
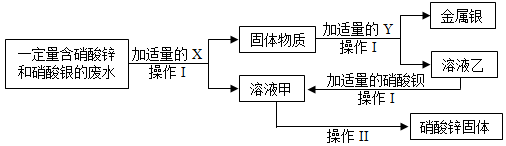
①X为 ;乙与硝酸钡反应的化学方程式为 。
②操作I和操作Ⅱ中都要用到一种玻璃仪器。该仪器在操作Ⅱ中的作用是什么?
(4)某工厂变废为宝,探究用废硫酸等来制取所需产品。现有废硫酸4.9 t(H2SO4的质量分数
为20%),与足量废铁屑反应来制取硫酸亚铁,同时将生成的全部氢气通入足量氧化铜中并加热
(H2+CuO Cu+H2O),请计算理论上最多可生产铜的质量。
Cu+H2O),请计算理论上最多可生产铜的质量。







