25℃时,已知弱酸的电离常数:Ka(CH3COOH)=1.8×10-5;Ka1(H2CO3)=4.4×10-7;
Ka2(H2CO3)=4.7×10-11;Ka(HClO)=4.0×10-8.则下列说法正确的是( )
- A.酸性强弱:HCO3-
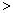 HClO
HClO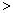 H2CO3
H2CO3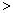 CH3COOH
CH3COOH - B.25℃时,0.1 mol·L-1的醋酸溶液比0.01mol·L-1的醋酸溶液的Ka大
- C.NaClO溶液中通入少量CO2的反应为:2NaClO+CO2+H2O
 Na2CO3+2HClO
Na2CO3+2HClO - D.体积相同、物质的量浓度相同的醋酸和次氯酸,分别用等物质的量浓度的NaOH溶液完全中和,消耗NaOH溶液的体积相同
答案
正确答案:D
知识点:电离平衡常数
A.相同温度下,电离平衡常数越大,酸性越强,酸性强弱:CH3COOH![]() H2CO3
H2CO3![]() HClO
HClO![]() HCO3-,A错误;
HCO3-,A错误;
B.电离平衡常数服从化学平衡常数的一般规律,它受温度影响,与溶液的浓度无关,温度一定,醋酸的电离常数一定,B错误;
C.酸性强弱:CH3COOH![]() H2CO3
H2CO3![]() HClO
HClO![]() HCO3-,向NaClO溶液中通入少量CO2,根据强酸制弱酸的原理,发生的反应为:NaClO+CO2+H2O
HCO3-,向NaClO溶液中通入少量CO2,根据强酸制弱酸的原理,发生的反应为:NaClO+CO2+H2O![]() NaHCO3+HClO,如果生成Na2CO3,由于HClO的酸性强于HCO3-,HClO会继续和Na2CO3反应生成NaHCO3,因此应生成NaHCO3而不是Na2CO3,C错误;
NaHCO3+HClO,如果生成Na2CO3,由于HClO的酸性强于HCO3-,HClO会继续和Na2CO3反应生成NaHCO3,因此应生成NaHCO3而不是Na2CO3,C错误;
D.体积相同、物质的量浓度相同的醋酸和次氯酸,酸的物质的量相同,由于醋酸和次氯酸均为一元酸,因此可用等体积、等物质的浓度的NaOH溶液完全中和,D正确。
故选D。
略







