25℃时,0.1mol·L-1的CH3COOH溶液pH=3,0.1mol·L-1的HCN溶液pH=4,下列说法正确的是( )
- A.CH3COOH与HCN均为弱酸,酸性强弱:HCN
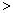 CH3COOH
CH3COOH - B.同浓度、同体积的CH3COOH溶液和HCN溶液中,[H+]较大的是HCN溶液
- C.25℃时,水电离出的[H+]相同的两种酸,酸的浓度:HCN
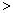 CH3COOH
CH3COOH - D.25℃时,pH均为3的CH3COOH与HCN溶液各100mL,分别与同浓度的NaOH溶液完全反应,消耗NaOH溶液的体积:CH3COOH
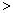 HCN
HCN
答案
正确答案:C
知识点:弱电解质的电离与溶液的pH
A.25℃时,相同浓度的CH3COOH溶液和HCN溶液,CH3COOH溶液的pH=3,HCN溶液的pH=4,说明CH3COOH溶液电离出来的[H+]大,则CH3COOH的酸性强于HCN,A错误;
B.同浓度、同体积的CH3COOH溶液和HCN溶液,酸性强的[H+]大,因此[H+]较大的是CH3COOH溶液,B错误;
C.水电离出的[H+]相同的两种酸,水电离出的[H+]等于水电离出的[OH-],根据Kw=[H+][OH-],则两种酸溶液中[H+]相同,CH3COOH的酸性强于HCN,当[H+]相同时,HCN溶液的浓度大于CH3COOH溶液,C正确;
D.CH3COOH的酸性强于HCN,pH相同、体积相同的两种酸,HCN的物质的量大于CH3COOH,因此与同浓度的NaOH溶液完全反应,HCN消耗NaOH溶液的体积大于CH3COOH,D错误。
故选C。
略







